Observe cada uma das fórmulas a seguir.
a) Identifique a função orgânica a que pertence cada uma dessas duas substâncias.
b) Qual dessas substâncias deve ter maior temperatura de ebulição? Justifique.
RESPOSTA:
a) H3C —O—CH3 Éter H3C—CH2—OH Álcool
Enfatize que na estrutura que apresenta um éter isso ocorre devido à presença de um oxigênio entre carbonos. No caso da estrutural que apresenta o álcool ressalte a presença da hidroxila ligada a um carbono saturado.
b) O álcool deve ter maior temperatura de ebulição, pois, apesar de sua massa molar ser é igual à do éter, suas moléculas se associam por ligações de hidrogênio, enquanto as do éter se associam por dipolo-dipolo. Quanto mais forte for a interação intermolecular, maior será a temperatura de ebulição. Discuta com os alunos quais interações intermoleculares existirão em cada um dos compostos e explique que a temperatura de ebulição está relacionada à energia necessária para o rompimento dessas interações. Procure sanar eventuais dúvidas dos alunos referentes à função orgânica e às propriedades físico-químicas trabalhadas (solubilidade e temperatura de ebulição). Se considerar oportuno, dê-lhes exemplos comparando as propriedades de compostos inorgânicos a fim de ajudá-los nessa compreensão.

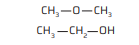


Nenhum comentário:
Postar um comentário