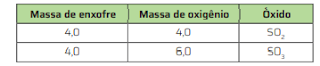
O enxofre, ao reagir com oxigênio, pode formar dois óxidos distintos: dióxido de enxofre e trióxido de enxofre. A tabela a seguir mostra diferentes valores de massa de oxigênio que reagem com 4,0 g de enxofre, levando à formação de cada um dos dois possíveis óxidos.
Sabendo que o enxofre apresenta o dobro da massa
atômica do oxigênio, faça o que se pede a seguir.
a) Copie a tabela no caderno e escreva nela a fórmula dos óxidos formados.
b) Determine a composição centesimal de cada um
dos óxidos.
RESPOSTA:
a) Sabendo que a massa atômica do enxofre equivale ao
dobro da massa atômica do oxigênio, quando a massa de
enxofre e a de oxigênio são as mesmas (4,0 g), pode-se
concluir que o óxido formado é o SO2. Quando a massa de
oxigênio é maior que a massa de enxofre, então, conclui-
-se que o óxido formado é o SO3.
b) SO2: Como a massa dos dois elementos é a mesma e a relação entre eles é de 1 : 2, temos 50% de S e 50% de O.
SO3: Como a massa de oxigênio é maior que a massa de
enxofre, e a relação entre eles é de 1 : 3, temos 40% de S
e 60% de O.